SEGUNDA UNIDAD
Fenómenos Biofísicos
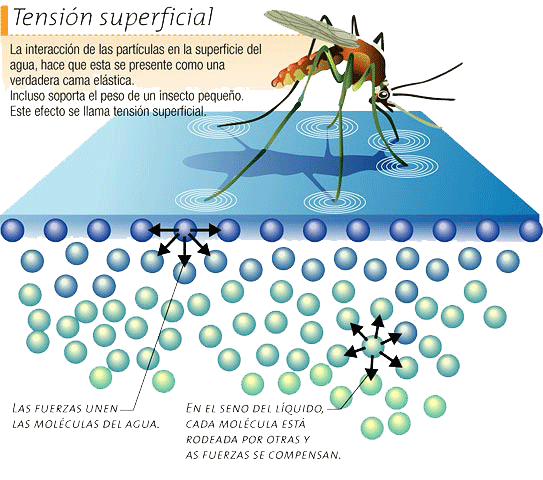
Tensión Superficial
Las fuerzas cohesivas entre las moléculas de un líquido, son las responsables del fenómeno conocido como tensión superficial. Las moléculas de la superficie no tienen otras iguales sobre todos sus lados, y por lo tanto se cohesionan más fuertemente, con aquellas asociadas directamente en la superficie. Esto forma una película de superficie, que hace más difícil mover un objeto a traves de la superficie, que cuando está completamente sumergido.
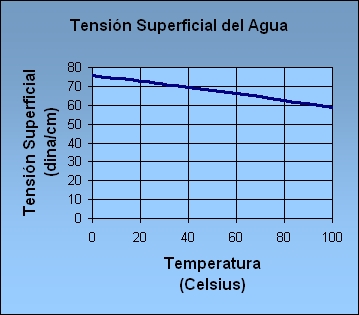
La tensión superficial, se mide normalmente en dinas/cm., la fuerza que se requiere (en dinas) para romper una película de 1 cm. de longitud. Se puede establecer de forma equivalente la energía superficial en ergios por centímetro cuadrado. El agua a 20°C tiene una tensión superficial de 72.8 dinas/cm comparada con 22.3 para el alcohol etílico y 465
• Es una manifestación de las fuerzas inter moleculares en los líquidos
• Esta definición implica que el líquido tiene una resistencia para aumentar su superficie. Este efecto permite a algunos insectos, como el zapatero, desplazarse por la superficie del agua sin hundirse
• Es la fuerza que actúa tangencialmente por unidad de longitud en el borde de una superficie libre de un líquido en equilibrio y que tiende a contraer dicha superficie.para el mercurio.
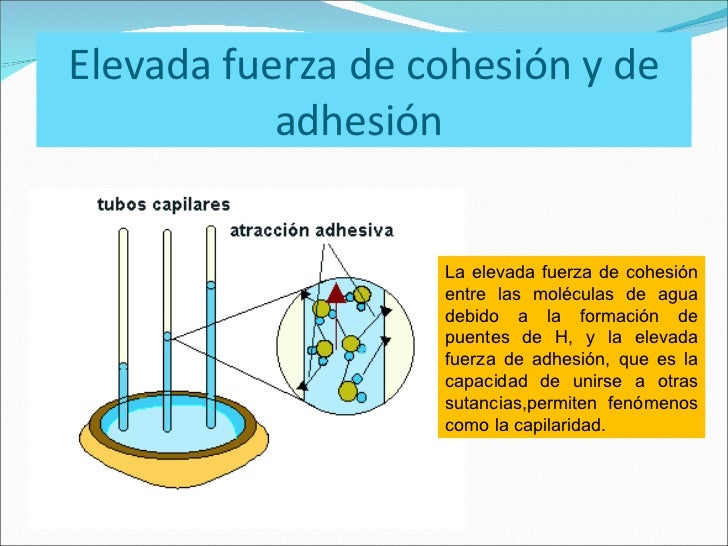
Cohesión y Adhesión
Las moléculas en estado líquido experimentan una fuerte fuerza de atracción intermolecular. Cuando esas fuerzas son entre moléculas iguales, entonces las referimos como fuerzas cohesivas. Por ejemplo, las moléculas de una gota de agua se mantienen unidas por fuerzas de cohesión, y las fuerzas de cohesión, especialmente fuerte en la superficie constituye la tensión superficial.
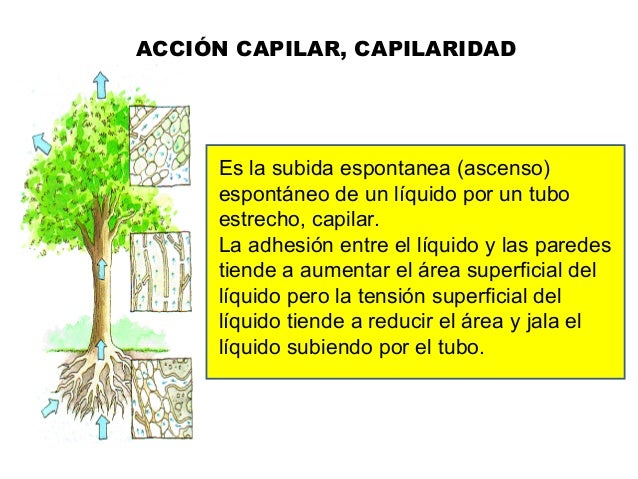
Cuando las fuerzas de atracción son entre moléculas diferentes, se dice que son fuerzas de adhesión. Las fuerzas de adhesión entre las moléculas de agua y las paredes de un tubo de vidrio, son más fuertes que las fuerzas cohesivas, con lo que se desarrolla un mecanismo de elevación del agua sobre las paredes de la vasija y contribuyendo por tanto a la acción capilar.
Las fuerzas atractivas entre las moléculas de un líquido, se pueden considerar como fuerzas electrostáticas residuales y algunas veces son llamadas fuerzas de van der Waals o adherencia van der Waals.
• Unas gotas de agua adhiriéndose a una telaraña
• El mortero usado para mantener y sostener juntos los ladrillos es un ejemplo de la adhesión
•La adhesión es la propiedad de la materia por la cual se unen dos superficies de sustancias iguales o diferentes cuando entran en contacto, y se mantienen juntas por fuerzas intermoleculares
• La cohesión es distinta de la adhesión. La cohesión es la fuerza de atracción entre partículas adyacentes dentro de un mismo cuerpo, mientras que la adhesión es la interacción entre las superficies de distintos cuerpos.
Cohesión y Tensión Superficial
Las fuerzas cohesivas entre las moléculas dentro de un líquido, están compartidas con todos los átomos vecinos. Las de la superficie, no tienen átomos por encima y presentan fuerzas atractivas más fuertes sobre sus vecinas próximas de la superficie. Esta mejora de las fuerzas de atracción intermoleculares en la superficie, se llama tensión superficial.
Prueba Clínica para la Ictericia (ejemplo de Tensión Superficial)
La orina normal, tiene una tensión superficial (T.S.) de unas 66 dinas/cm., pero si está presente la bilis (una prueba para la ictericia), cae a unos 55. En la prueba de heno, se esparce polvo de azufre sobre la superficie de la orina. El polvo flotará en la orina normal, pero se hundirá si la T.S. baja por la bilis.
•Es la atracción entre moléculas que mantiene unidas las partículas de una sustancia
•Es la fuerza de atracción entre partículas adyacentes dentro de un mismo cuerpo
•En el agua la fuerza de cohesión es elevada por causa de los puentes de hidrogeno que mantienen las moléculas de agua fuertemente unidas, formando una estructura compacta que la convierte en un líquido casi incompresible
Diálisis
Es paso de moléculas del solvente a menor concentración a través de la membrana.
Osmosis
Es el paso de moléculas de solventes o del agua de una región de mayor concentración a otra de menor concentración a través de la membrana
La ósmosis es un fenómeno físico relacionado con el comportamiento de un sólido como soluto de una solución ante una membrana semipermeable para el solvente pero no para los solutos.
Tal comportamiento entraña una difusión simple a través de la membrana, sin "gasto de energía". La ósmosis del agua es un fenómeno biológico importante para el metabolismo celular de los seres vivos.
Difusión
Es el paso de moléculas de mayor a menor concentración debido a la energía cinética de las mismas
Adsorción
La adsorción es un proceso por el cual átomos, iones o moléculas son atrapados o retenidos en la superficie de un material en contraposición a la absorción, que es un fenómeno de volumen. Es decir es un proceso en el cual un contaminante soluble (adsorbato) es eliminado del agua por contacto con una superficie sólida (adsorbente). El proceso inverso a la adsorción se conoce como desorción.
En química, la adsorción de una sustancia es su acumulación en una determinada superficie interfacial entre dos fases. El resultado es la formación de una película líquida o gaseosa en la superficie de un cuerpo sólido o líquido.
Considérese una superficie limpia expuesta a una atmósfera gaseosa. En el interior del material, todos los enlaces químicos (ya sean iónicos, covalentes o metálicos) de los átomos constituyentes están satisfechos. En cambio, por definición la superficie representa una discontinuidad de esos enlaces. Para esos enlaces incompletos, es energéticamente favorable el reaccionar con lo que se encuentre disponible, y por ello se produce de forma espontánea.
Atracción capilar, o capilaridad
Acción capilar
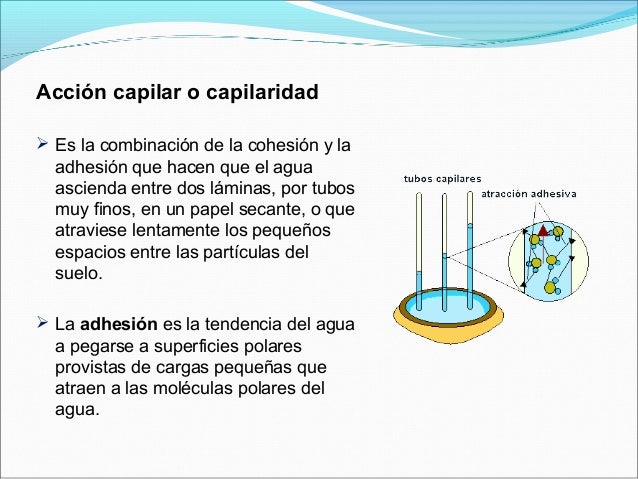
La acción capilar, o capilaridad, movimiento capilar o de mecha se refiere a dos fenómenos:
Un aparato común utilizado para demostrar el primer fenómeno es el tubo capilar. Cuando el extremo inferior de un tubo vertical de vidrio se coloca en un líquido tal como agua, se forma un menisco cóncavo. Las fuerzas de adhesión entre el líquido y la pared interior sólido tira de la columna de líquido hasta que hay una masa suficiente de líquido para las fuerzas gravitacionales para superar estas fuerzas intermoleculares. La longitud de contacto entre la parte superior de la columna de líquido y el tubo es proporcional al diámetro del tubo, mientras que el peso de la columna de líquido es proporcional al cuadrado del diámetro del tubo, por lo que un tubo estrecho se dibuje una columna de líquido mayor que un tubo de ancho.
Ejemplos
La acción capilar es esencial para el drenaje de fluido lacrimal producido constantemente desde el ojo. Dos canalículos de pequeño diámetro están presentes en la esquina interna del párpado, también llamados los conductos lagrimales, sus aberturas se pueden ver a simple vista en los sacos lagrimales cuando se eversión de los párpados.
Capilaridad es la absorción de un líquido por un material en la forma de una mecha de la vela. Las toallas de papel absorben líquido a través de la acción capilar, permitiendo que un fluido a ser transferido de una superficie de la toalla. Los pequeños poros de un acto esponjan como pequeños capilares, haciendo que se absorba una cantidad comparativamente grande de líquido. Algunas telas se dice que utilizar la acción capilar para "absorber" el sudor de la piel. Estos se conocen como efecto de mecha tejidos, después de las propiedades capilares de la vela y la lámpara de mechas a menudo.
La acción capilar se observa en la cromatografía de capa delgada, en el que un disolvente se mueve verticalmente hasta una placa a través de la acción capilar. En este caso, los poros son huecos entre partículas muy pequeñas.
Con algunos pares de materiales, tales como el mercurio y el vidrio, las fuerzas intermoleculares dentro del líquido exceden las que existen entre el sólido y el líquido, por lo que se forma un menisco convexo y obras de acción capilar a la inversa.
En hidrología, la acción capilar describe la atracción de las moléculas de agua a las partículas del suelo. La acción capilar es responsable del movimiento de las aguas subterráneas de las zonas húmedas de la tierra en las zonas secas. Las diferencias en la unidad de suelo potencial acción capilar en el suelo.
Altura de un menisco
La altura h de una columna de líquido está dada por: donde es la tensión superficial líquido-aire,? es el ángulo de contacto,? es la densidad del líquido, g es la fuerza del campo gravitacional local de, y r es el radio del tubo.
Para un tubo de vidrio lleno de agua en el aire en condiciones normales de laboratorio = 0,0728 N/ma 20 C,? = 0,? es de 1000 kg/m3, y g = 9,81 m/s2. Para estos valores, la altura de la columna de agua es
Así, para un tubo de vidrio de 4 m de diámetro en condiciones de laboratorio dados anteriormente, el agua se elevaría un imperceptible 0,007 mm. Sin embargo, para un tubo de diámetro 4 cm, el agua se elevaría 0,7 mm, y para un tubo de diámetro de 0,4 mm, el agua se elevaría 70 mm.
Se define como el movimiento del agua dentro de los espacios de un material poroso, debido a las fuerzas de adhesión y a la tensión de la superficie.
La acción capilar ocurre porque el agua es pegajosa -- las moléculas del agua se pegan unas a otras y a otras substancias como el vidrio, la ropa, tejidos orgánico y la tierra.
Difusión simple
•Es el proceso por el cual se produce un flujo neto de moléculas pasa a través de una membrana permeable sin que exista un aporte externo de energía
•El proceso de difusión simple es de vital importancia para el transporte de moléculas pequeñas a través de las membranas celulares.
•Es el único mecanismo por el cual el oxígeno ingresa a las células que lo utilizan como aceptor final de electrones en la cadena respiratoria y uno de los principales mecanismos de regulación osmótica en las células.
Transporte de líquidos en un medio poroso
Cuando un medio poroso seco, tal como un ladrillo o una mecha, se pone en contacto con un líquido, que comenzará a absorber el líquido a una velocidad que disminuye con el tiempo. Para una barra de material con área de sección transversal A que se humedece en un extremo, el acumulado volumen V de líquido absorbido después de un tiempo t es donde S es la capacidad de absorción del medio, con unas dimensiones m/s1/2 o mm/min1/2. La cantidad se llama la ingesta de líquido acumulado, con la dimensión de la longitud. La longitud humedecida de la barra, que es la distancia entre el extremo mojado de la barra y el llamado frente húmedo, depende de la fracción f del volumen ocupado por el líquido. Este número f es la porosidad del medio, la longitud humedecida es a continuación
Algunos autores utilizan la cantidad de S/f como la capacidad de absorción. La descripción anterior es para el caso donde la gravedad y la evaporación no juegan un papel.
Capacidad de absorción es una propiedad importante de materiales de construcción, ya que afecta a la cantidad de humedad ascendente. Algunos valores para la capacidad de absorción de los materiales de construcción están en la tabla de abajo.
Fenómeno Físico y Químico
Termometría
La termometríase encarga de la medición de la temperatura de cuerpos o sistemas. Para este fin, se utiliza el termómetro, que es un instrumento que se basa en el cambio de alguna propiedad de la materia debido al efecto del calor; así se tiene el termómetro de mercurio y de alcohol, que se basan en la dilatación, los termopares que deben su funcionamiento al cambio de la conductividad eléctrica, los ópticos que detectan la variación de la intensidad del rayo emitido cuando se refleja en un cuerpo caliente.
Para poder construir el termómetro se utiliza el Principio Cero de la Termodinámica que dice: "Si un sistema A que está en equilibrio térmico con un sistema B, está en equilibrio térmico también con un sistema C, entonces los tres sistemas A, B y C están en equilibrio térmico entre sí".
•Encargado de la medición de la temperatura de cuerpos o sistemas
•Se utiliza el termómetro, que es un instrumento que se basa en el cambio de alguna propiedad de la materia debido al efecto del calor
•Los diferentes tipos de termómetro son el de mercurio y de alcohol, que se basan en la dilatación los termopares cuyo funcionamiento es el cambio de la conductividad eléctrica, cuya variación de la intensidad del rayo que emite cuando se refleja en un cuerpo caliente son detectados por los ojo
Fenomenos quimicos
Son los cambios que presentan las sustancias cuando, al reaccionar unas con otras, pierden sus características originales y dan lugar a otra sustancia, con propiedades diferentes.
Ejemplos:
• Combustión
• Oxidación
• Reacción de un compuesto al combinarse con otro
• La elasticidad en si es un ejemplo de fenómeno físico químico ya que al estirarse se prolonga su estado normal pero al volverse se vuelve normal o a su estado original
Calorimetría
La calorimetría mide el calor en una reacción química o un cambio de estado usando un instrumento llamado calorímetro. Pero también se puede emplear un modo indirecto calculando el calor que los organismos vivos producen a partir de la producción de dióxido de carbono y de nitrógeno (urea en organismos terrestres), y del consumo de oxígeno.
ΔU = cambio de energía interna
Como la presión no se mantiene constante, el calor medido no representa el cambio de entalpía.
Energía
Es la capacidad de un sistema físico para realizar un trabajo. Tenemos dos clases de energía cinética y energía potencial la Energía Cinética es la energía asociada al movimiento y la Energía potencial es la energía relacionada con la posición.
Calor
Se define como una energía relacionada con el movimiento de átomos y moléculas de la materia
Trabajo
Producto de una fuerza aplicada sobre un cuerpo y del desplazamiento del cuerpo en la dirección de esta fuerza, mientras se realiza trabajo sobre el cuerpo, se produce una transferencia de energía al mismo; el trabajo es energía en movimiento.
Temperatura
Es la sensación de calor o frío al tocar una sustancia depende de su temperatura, de la capacidad de la sustancia para conducir el calor y de otros factores
Escalas Termométricas
En la actualidad se emplea diferentes escalas temperatura. Entre ellas tenemos:
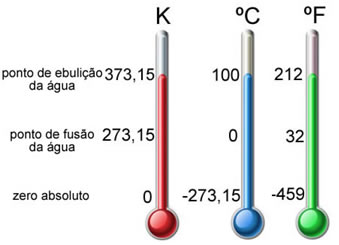
ESCALA CELSIUS.- Llamada también centígrada asigna el valor cero al punto de congelación o solidificación del agua y el valor 100 al punto de ebullición de la misma a la presión de una atmósfera.
ESCALA KELVIN O ABSOLUTA.- La escala absoluta o termodinámica de temperatura más empleada, el cero se define como el cero absoluto de temperatura, es decir -273,15ºc
ESCALA FAHRENHEIT.- Es otra escala de temperatura muy utilizada en Norte América para medidas no científicas y en ella el punto de congelación de agua se la define como 32ºf, y su punto de ebullición como 212ºf
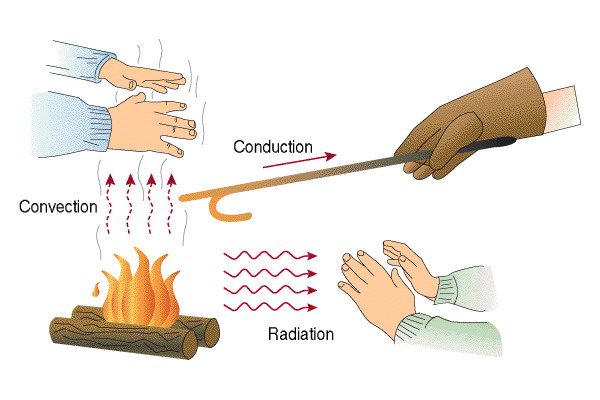
Transmisión del calor
Hay tres formas de transmisión del calor que son:
Conducción.- Se produce el intercambio de calor por contacto directo entre los dos cuerpos, las moléculas transmiten su energía al otro cuerpo hasta que alcanzan el equilibrio.
Convección.- Se produce en los gases y en los líquidos y consiste en que los fluidos más calientes son más ligeros que los fríos por lo que tienden a subir mientras que los fríos bajan formando corrientes de convección.
Radiación.-Es la propagación de la energía térmica sin que exista contacto entre los dos cuerpos. La radiación se produce en el espacio vacío y es como el Sol calienta la tierra.
Leyes de la termodinámica
Principio cero de la termodinámica
Este principio o ley cero, establece que existe una determinada propiedad denominada temperatura empírica θ, que es común para todos los estados de equilibrio termodinámico que se encuentren en equilibrio mutuo con uno dado.
En palabras llanas: «Si pones en contacto un objeto con menor temperatura con otro con mayor temperatura, ambos evolucionan hasta que sus temperaturas se igualan».
El equilibrio termodinámico de un sistema se define como la condición del mismo en el cual las variables empíricas usadas para definir o dar a conocer un estado del sistema (presión, volumen, campo eléctrico, polarización, magnetización, tensión lineal, tensión superficial, coordenadas en el plano x, y) no son dependientes del tiempo. El tiempo es un parámetro cinético, asociado a nivel microscópico; el cual a su vez está dentro del físico químico y no es parámetro debido a que a la termodinámica solo le interesa trabajar con un tiempo inicial y otro final. A dichas variables empíricas (experimentales) de un sistema se las conoce como coordenadas térmicas y dinámicas del sistema.
Este principio fundamental, aun siendo ampliamente aceptado, no fue formulado formalmente hasta después de haberse enunciado las otras tres leyes. De ahí que recibiese el nombre de principio cero.
Primera ley de la termodinámica
En palabras llanas: "La energía no se crea ni se destruye: solo se transforma" (conservación de la energía)
La energía puede convertirse de una forma a otra, pero no puede crearse ni destruirse. La energía puede almacenarse en varias formas y luego transformarse en otras. A juicio de esta ley, todas las formas de energía son Intercambiables entre sí. Es decir que, cualquier forma de energía puede transformarse en otra. Lo único que no ocurrirá, será la creación de nueva energía, o la destrucción de la misma. • Cuando los organismos oxidan carbohidratos, convierten la energía almacenada en los enlaces químicos en otras formas de energía. En el caso de las reacciones químicas, esto significa que la suma de la energía de los productos de la reacción y la de la energía liberada en la reacción misma es igual a la energía inicial de las sustancias que reaccionan.
La principal fuente de energía en el organismo la constituyen los carbohidratos que ingerimos en nuestra alimentación.
La transformación de energía en el organismo, se realiza oxidando esencialmente glucosa en el proceso de respiración, mediante mecanismos moleculares realizados a nivel celular, a temperatura constante y baja.
Segunda ley de la termodinámica
Esta ley marca la dirección en la que deben llevarse a cabo los procesos termodinámicos y, por lo tanto, la imposibilidad de que ocurran en el sentido contrario (por ejemplo, que una mancha de tinta dispersada en el agua pueda volver a concentrarse en un pequeño volumen). También establece, en algunos casos, la imposibilidad de convertir completamente toda la energía de un tipo en otro sin pérdidas. De esta forma, la segunda ley impone restricciones para las transferencias de energía que hipotéticamente pudieran llevarse a cabo teniendo en cuenta sólo el primer principio. Esta ley apoya todo su contenido aceptando la existencia de una magnitud física llamada entropía, de tal manera que, para un sistema aislado (que no intercambia materia ni energía con su entorno), la variación de la entropía siempre debe ser mayor que cero.
Debido a esta ley también se tiene que el flujo espontáneo de calor siempre es unidireccional, desde los cuerpos de mayor temperatura hacia los de menor temperatura, hasta lograr un equilibrio térmico.
La aplicación más conocida es la de las máquinas térmicas, que obtienen trabajo mecánico mediante aporte de calor de una fuente o foco caliente, para ceder parte de este calor a la fuente o foco o sumidero frío. La diferencia entre los dos calores tiene su equivalente en el trabajo mecánico obtenido.
Existen numerosos enunciados equivalentes para definir este principio, destacándose el de Clausius y el de Kelvin.
Enunciado de Clausius
En palabras de Sears es: «No es posible ningún proceso cuyo único resultado sea la extracción de calor de un recipiente a una cierta temperatura y la absorción de una cantidad igual de calor por un recipiente a temperatura más elevada».
Enunciado de Kelvin—Planck
Es imposible construir una máquina térmica que, operando en un ciclo, no produzca otro efecto que la absorción de energía desde un depósito, con la realización de una cantidad igual de trabajo.
Otra interpretación
Es imposible construir una máquina térmica cíclica que transforme calor en trabajo sin aumentar la energía termodinámica del ambiente. Debido a esto podemos concluir, que el rendimiento energético de una máquina térmica cíclica que convierte calor en trabajo, siempre será menor a la unidad, y ésta estará más próxima a la unidad, cuanto mayor sea el rendimiento energético de la misma. Es decir, cuanto mayor sea el rendimiento energético de una máquina térmica, menor será el impacto en el ambiente, y viceversa.
Los seres humanos efectuamos trabajo al caminar, correr, levantar un objeto, etc., para realizarlo requerimos de energía que el organismo obtiene al transformar la energía potencial química de los alimentos. Para las actividades antes mencionadas se asocia el concepto de eficiencia muscular (E), como el cociente del trabajo mecánico realizado y la energía suministrada al cuerpo, a través de los alimentos. Se ha verificado que la eficiencia muscular en el trabajo mecánico es aproximadamente del 20%, (E = 0.2).
Tercera ley de la termodinámica
Algunas fuentes se refieren incorrectamente al postulado de Nernst como "la tercera de las leyes de la termodinámica". Es importante reconocer que no es una noción exigida por la termodinámica clásica por lo que resulta inapropiado tratarlo de «ley», siendo incluso inconsistente con la mecánica estadística clásica y necesitando el establecimiento previo de la estadística cuántica para ser valorado adecuadamente. La mayor parte de la termodinámica no requiere la utilización de este postulado. El postulado de Nernst, llamado así por ser propuesto por Walther Nernst, afirma que es imposible alcanzar una temperatura igual al cero absoluto mediante un número finito de procesos físicos. Puede formularse también como que a medida que un sistema dado se aproxima al cero absoluto, su entropía tiende a un valor constante específico. La entropía de los sólidos cristalinos puros puede considerarse cero bajo temperaturas iguales al cero absoluto.
Es importante remarcar que los principios o leyes de la termodinámica son válidas siempre para los sistemas macroscópicos, pero inaplicables a nivel microscópico. La idea del demonio de Maxwell ayuda a comprender los límites de la segunda ley de la termodinámica jugando con las propiedades microscópicas de las partículas que componen un gas.
Entropía es una magnitud física que, mediante cálculo, permite determinar la parte de la energía que no puede utilizarse para producir trabajo
Entalpia es una variación que expresa una medida de la cantidad de energía absorbida o cedida por un sistema termodinámico, es decir, la cantidad de energía que un sistema intercambia con su entorno.
Transformación de la materia en energía
Las definiciones de materia y energía son:
Materia, en ciencia, término general que se aplica a todo lo que ocupa espacio y posee los atributos de gravedad e inercia.
En la física clásica, la materia y la energía se consideraban dos conceptos diferentes que estaban detrás de todos los fenómenos físicos.
Los físicos modernos, sin embargo, han demostrado que es posible transformar la materia en energía y viceversa, con lo que han acabado con la diferenciación clásica entre ambos conceptos. Sin embargo, al tratar numerosos fenómenos —como el movimiento, el comportamiento de líquidos y gases, o el calor— a los científicos les resulta más sencillo y práctico seguir considerando la materia y la energía como entes distintos.
Energía, capacidad de un sistema físico para realizar trabajo. La materia posee energía como resultado de su movimiento o de su posición en relación con las fuerzas que actúan sobre ella. Se considera una propiedad de los cuerpos que les permite transformar cuerpos. Sin energía, no será posible ningún proceso físico, químico o biológico.
Principio de conservación de la materia – energía
Por muchos años se trabajaron de manera independiente las leyes de la energía y la masa. Se establecía que la energía total de un sistema se mantenía constante, así como el total de la masa. Por ejemplo, la energía podría pasar de cinética a potencial y la masa cambiar de estado. Ambos pueden tener cambios, pero ni la masa ni la energía pueden ser creadas ni destruidas.
Estos conceptos fueron relacionados por la teoría de la relatividad de Albert Einstein. Esta teoría establece que la masa es una forma de energía, como lo indica la formula E = m•c². En resumen, significa que la materia no es más que una forma de energía, descubrimiento que tuvo (y tiene) unas consecuencias impactantes en el mundo de la Física.
En la naturaleza, el sol, por medio de la fusión de los núcleos de hidrogeno, libera gran cantidad de energía. Estas conversiones de materia en energía y viceversa son a lo que se le conoce como la conservación de la masa - energía.
Hagámonos la pregunta, ¿es posible recorrer el camino inverso y convertir energía en materia?
La respuesta, evidentemente, es que sí. ¿Por qué no? Sólo hay un ‘pequeño’ detalle. Una ínfima cantidad de masa produce una cantidad ingente de energía. Un gramo de materia desintegrada produciría aproximadamente 90 Terajuls . Esto son unos 25 millones de kilovatios-hora. Con esta energía, podríamos hacer lucir una bombilla de 100 vatios durante 285 siglos.
Pero al convertir energía en materia todo funciona al revés. Necesitamos una cantidad de energía espectacular para producir una cantidad de materia pequeñísima. Por ejemplo, un fotón gamma muy energético puede dar lugar a un electrón y un positrón.
Podemos, por tanto, producir partículas subatómicas a partir de energía, pero sólo tiene interés a nivel científico, experimental.
Se supone que toda la materia del Universo se originó a partir de energía, pero evidentemente en unas condiciones imposibles de reproducir sobre la faz de la Tierra. En general, aunque la energía no se crea ni se destruye sino que se transforma no todas las transformaciones son igual de viables.
Por ejemplo, podemos convertir totalmente la energía mecánica en calor, por ejemplo, al frenar un coche pero no podemos transformar totalmente el calor en energía mecánica (esto violaría las leyes de la Termodinámica). En el caso que nos ocupa, aunque los humanos hayamos controlado el proceso de transformación de la materia en energía, el paso inverso es físicamente imposible para nosotros.
Las observaciones del siglo XIX llevaron a la conclusión de que la energía ni se crea ni se destruye, pero si se transforma. Este concepto, es conocido como principio de la conservación de la energía. Cuando las velocidades se aproximan a la de la luz la materia se transforma en energía y viceversa.
Transformación de la energía en materia
Para que la materia se convierta en energía debe unirse con antimateria, la antimateria está formada con antipartículas es decir partículas con cargas opuestas a las partículas normales, al unirse materia y antimateria se convierten en energía, la transformación de la energía en materia cosa que se logró en muy pequeña escala es el proceso inverso la energía se convierte en partícula y antipartícula, la antimateria solo puede crearse en los laboratorios por eso para realizar las transformaciones es muy complicado.
Transformación de materia en energía
La experiencia demuestra que conforme la energía va siendo utilizada para promover cambios en la materia va perdiendo capacidad para ser empleada nuevamente. El principio de la conservación de la energía hace referencia a la cantidad, pero no a la calidad de la energía, la cual está relacionada con la posibilidad de ser utilizada. Así, una cantidad de energía concentrada en un sistema material es de mayor calidad que otra igual en magnitud, pero que se halle dispersa.
Aun cuando la cantidad de energía se conserva en un proceso de transformación, su calidad disminuye. Todas las transformaciones energéticas asociadas a cambios materiales, acaban antes o después en energía térmica; ésta es una forma de energía muy repartida entre los distintos componentes de la materia, por lo que su grado de aprovechamiento es peor. Este proceso de pérdida progresiva de calidad se conoce como degradación de la energía y constituye otra de las características de esta magnitud o atributo que han identificado los físicos para facilitar el estudio de los sistemas materiales y de sus transformaciones.
Transformaciones químicas.
Son aquellas en que las sustancias que intervienen presentan cambios en su constitución. Las transformaciones o cambios químicos se denominan reacciones químicas, donde por una redistribución de los átomos, una o varias sustancias (reactivos) se transforman en otra sustancias (producto de la reacción).
COMBUSTION
Es una transformación química en la cual un combustible (gasolina, gas, carbón, alcohol, madera) se combina con el oxígeno. La combustión es una reacción de tipo exotérmica donde se forma una llama que desprende calor al quemar, y luz al arder. La combustión se produce con la sola presencia de oxígeno o con sustancias que lo contengan, como el aire atmosférico. Tras la combustión se originan sustancias gaseosas, entre ellas dióxido de carbono, vapor de agua, monóxido de carbono, nitrógeno y carbono en forma de hollín.
Temperatura de los seres vivos
La temperatura de los seres vivos no depende solo de la temperatura ambiente, y hay otros factores actuando. El balance de calor y radiación expresa los intercambios de energía y calor de un organismo con el medio. Por ejemplo, una hoja está sometida a muchos flujos de intercambio: del sol recibe radiación de onda corta, radiación visible y radiación de onda larga. Además, tanto la atmósfera como los cuerpos cercanos emiten radiación infrarroja. La mayor parte de esta radiación acaba transformándose en calor y como consecuencia la hoja adquiere una determinada temperatura y también emite radiación infrarroja.
Cuando se establece una diferencia de temperatura entre la hoja y la atmósfera, estas diferencias tienden a anularse a causa de otras transferencias de calor:
- Calor sensible: la hoja lo intercambia por contacto directo con las moléculas de aire y las moléculas de su superficie.
- Calor latente: va asociado a los cambios de temperatura del agua: se intercambia por evaporación y condensación.
Efectos de la temperatura sobre los seres vivos:
Todos los organismos tienen una temperatura óptima en la que pueden llevar a cabo todas sus actividades
Efectos letales de la temperatura:
A. Los descensos de temperatura pueden producir la muerte, sobre todo cuando esta se sitúa por debajo del punto de congelación del agua: se producen cristales de hielo en el organismo, por lo que desciende el agua disponible y el ser vivo muere por desecación. Además, los cristales de hielo también pueden ejercer un efecto mecánico sobre los tejidos y romperlos.
Adaptaciones para sobrevivir a las bajas temperaturas:
– Resistencia a la desecación: pierden el agua de los tejidos, así esta no se congela. Esto sucede en esporas de resistencia y en las larvas de algunos insectos.
- Reducción del punto de congelación del agua o efecto crioscópico. Muchos insectos, por ejemplo, aumentan las concentraciones de glicerina en sus líquidos internos cuando llega la época de frío.
B. Los aumentos de temperatura tienen un efecto directo sobre el funcionamiento de las proteínas, ya que las enzimas se desnaturalizan a determinadas temperaturas. Y, de forma indirecta, el aumento de temperatura produce la pérdida de agua por transpiración. En medios acuáticos, además, baja la concentración del oxígeno disuelto en ella.
Radiación térmica
Se denomina radiación térmica o radiación calorífica a la emitida por un cuerpo debido a su temperatura. Todos los cuerpos emiten radiación electromagnética, pero su intensidad depende de la temperatura y de la longitud de onda considerada.
En lo que respecta a la transferencia de calor la radiación relevante es la comprendida en el rango de longitudes de onda de 0,1µm a 100µm, abarcando por tanto parte de la región ultravioleta, la visible y la infrarroja del espectro electromagnético.
La materia en un estado condensado (sólido o líquido) emite un espectro de radiación continuo. La frecuencia de onda emitida por radiación térmica es una densidad de probabilidad que depende solo de la temperatura.
Un cuerpo negro hace referencia a un objeto opaco que emite radiación térmica. Un cuerpo negro perfecto es aquel que absorbe toda la luz incidente y no refleja nada. A temperatura ambiente, un objeto de este tipo debería ser perfectamente negro (de ahí procede el término cuerpo negro.). Sin embargo, si se calienta a una temperatura alta, un cuerpo negro comenzará a brillar produciendo radiación térmica.
A temperatura ambiente, vemos los cuerpos por la luz que reflejan, dado que por sí mismos no emiten luz. Si no se hace incidir luz sobre ellos, si no se los ilumina, no podemos verlos. A temperaturas más altas, vemos los cuerpos debido a la luz que emiten, pues en este caso son luminosos por sí mismos. Así, es posible determinar la temperatura de un cuerpo de acuerdo a su color, pues un cuerpo que es capaz de emitir luz se encuentra a altas temperaturas.
Los cuerpos calientes emiten una radiación electromagnética cuya distribución de frecuencias sólo depende de su temperatura Y cuánto más caliente está, más alta es la media de las frecuencias emitidas.
De este modo, cuando un objeto está caliente emite frecuencias infrarrojas y se puede ver en la oscuridad con un visor de infrarrojos. Si sube más la temperatura, la radiación se ve claramente, porque a partir de cierta temperatura la radiación emitida empieza a estar en la parte baja de la banda visible, es decir en el rojo.
Por eso cuando un objeto está muy caliente se pone rojo y decimos que está al "rojo vivo".
Y cuando se calienta aún más emite radiación en toda la banda visible, en consecuencia se pone blanco y decimos que está al "rojo blanco".
La radiación emitida absorbe parte del calor del cuerpo y "la radia" al espacio circundante, de tal forma que el calor se trasmite por el espacio y es capaz de calentar otros objetos a distancia aunque no haya ningún medio físico entre ellos.
La relación entre la temperatura de un cuerpo y el espectro de frecuencias de su radiación emitida se utiliza en los pirómetros
Termodinámica en los Seres Vivos
En el fondo somos química: la vida es la expresión de miles de reacciones químicas que tienen lugar continuamente en el interior de los organismos vivos. Como esas reacciones son propias de los seres vivos se les denomina con más propiedad reacciones bioquímicas.
Hay que recordar que una reacción consta de uno o varios reactivos que se combinan para transformarse en uno o varios productos. La Química nos dice que las reacciones pueden ser de dos tipos. Por una parte, las que se producen espontáneamente, es decir, aquellas en las que los reactivos dan lugar a unos determinados productos de forma espontánea. Por otra parte, están aquellas que nos son espontáneas. Casualmente, las más importantes reacciones bioquímicas, esenciales para la vida, no son espontáneas. Por ejemplo, la síntesis de proteínas.
Las reacciones pueden ser de dos tipos:
Las que se producen espontáneamente: Aquellas en las que los reactivos dan lugar a unos determinados productos de forma espontánea.
Las que nos son espontáneas: Las más importantes reacciones bioquímicas, esenciales para la vida
Reacción Espontánea
Es cuando el incremento de su energía libre estándar es negativo
Pasa de poseer unos reactivos altamente energéticos a unos productos de menor poder energético y los reactivos han perdido una energía que ha sido transferida a otro sistema: de ahí el valor negativo de su energía libre.
Reacciones No Espontáneas
Es cuando el incremento de energía libre es positivo. Ejemplo: La síntesis de proteínas.
Energía libre
Es la energía disponible para realizar trabajo, es decir que es útil para producir cambios
La energía libre o energía libre de Gibbs se representa por el símbolo G.: El incremento de energía libre se representa por ∆G y se mide en julios (J) o kilojulios (kj). Más concretamente en kj/mol.
Proceso de la Alimentación - Procesos que transforman los alimentos
Los alimentos, en su mayoría formados por moléculas complejas, se transforman o degradan en otras más sencillas y pequeñas, condición de importancia para su absorción.
Ingestión
Proceso de incorporación de alimentos a través de la boca
Digestión
Serie de procesos que ocurre en diversos órganos del sistema digestivo y que transforman los alimentos
Transformación física
Fragmenta los alimentos en porciones más pequeñas a través de la masticación en la boca y de los movimientos peristálticos a lo largo del tubo digestivo
Transformación química
En la boca, estómago e intestino delgado las enzimas digestivas desdoblan el alimento transformándolo en moléculas más sencillas.
Absorción
Los nutrientes representados por moléculas sencillas pasan del sistema digestivo a la sangre para ser distribuidos a todo el cuerpo
Agestiones
Es el proceso a través del cual se expulsan los desechos de la digestión como materia fecal hacia el exterior
Estrategia del Metabolismo
Forma ATP, puede ser reductor y precursores para la biosíntesis. Revisemos brevemente estos temas centrales
El ATP es la unidad biológica universal de energía. El elevado potencial para transferir grupos fosforillos capacita al ATP para ser utilizado como fuente de energía en la contracción muscular, transporte activo, amplificación de señales y biosíntesis.








No hay comentarios:
Publicar un comentario